Xin phép anh/chị hôm nay chúng ta đàm luận về Gene Editing – tạm dịch là “sửa đổi gen”.
Tế bào của tất cả các loài sinh vật trên Trái Đất (có thể là cả ở trong Vũ trụ nữa) chứa trong lõi của nó một bộ mã – bộ mã này chính là DNA. Trong một bài đàm luận lần trước, tôi đã nói đến việc giải mã DNA. Chủ đề lần này xin phép anh/chị chúng ta đàm luận về cách sửa đổi DNA – thực chất là sửa đổi gen – can thiệp trực tiếp vào bộ mã sự sống. Nhằm rút gọn bài post, bài này tôi chỉ xin phép nói về phương pháp sửa đổi gen CRISPR-Cas9 – giải pháp đã gây chấn động giới khoa học. Chú ý rằng bên cạnh phương pháp CRISPR-Cas9, các nhà khoa học còn sử dụng nhiều giải pháp khác như Restriction enzyme, Zinc finger nucleases (ZFN), Transcription activator-like effector nucleases (TALEN), Base editing (BE), Prime editing, Programmable Addition via Site-specific Targeting Elements (PASTE).
~
Để giúp anh/chị quyết định có đọc tiếp hay không, tôi xin phép cung cấp các thông tin liên quan đến bài post này như sau:
- Chủ đề: Bioinformatics, DNA (DeoxyriboNucleic Acid)
- Tính thời sự: năm 2020
- Thời gian đọc: 7 phút, không tính thời gian uống cà phê
🧬
① Đề dẫn
Để cho dễ hình dung, chúng ta tưởng tượng rằng chuỗi DNA giống như chuỗi các ký tự trong lập trình. Mỗi một phần tử trong chuỗi DNA là một bp (base pair). Tôi tạm dịch base pair là cặp cơ số (A ↔ T, C ↔ G). Chuỗi DNA là chuỗi sợi xoắn kép, là bộ mã của tất cả các loài sinh vật. Mỗi một cá thể trong cùng loài lại có bộ mã riêng. Chẳng hạn, mỗi cá nhân loài người đều có bộ mã riêng, không ai giống ai.
Bên lề ▼ Bộ mã DNA đóng vai trò gì?
- Anh/chị có thể tham khảo bài tôi đã đăng trên diễn đàn này vào ngày 10-01-2021 tại đây.
- Một cách tóm tắt: tế bào đọc mã DNA để sản xuất ra protein; protein điều hành sự sống.
Bên lề ▲
-
Chúng ta có thể coi việc sửa đổi gen là việc thay một đoạn DNA này bằng một đoạn DNA khác. Để cho dễ hiểu, tôi ví việc sửa đổi gen tương tự như việc thay một đoạn ký tự này bằng một đoạn ký tự khác trong chuỗi ký tự.
-
Trong lập trình thì việc thay một đoạn ký tự này bằng một đoạn ký tự khác rất đơn giản. Tôi lấy ví dụ chúng ta có chuỗi ký tự “Diễn đàn ICT dành cho các nhà nghiên cứu, giảng dạy và quản lý ICT”. Bây giờ chúng ta muốn đổi đoạn ký tự “ICT” thành “CNTT-TT”. Nếu ngôn ngữ lập trình là Python thì đoạn mã sau giải vấn đề này:
txt = "Diễn đàn ICT dành cho các nhà nghiên cứu, giảng dạy và quản lý ICT"
x = txt.replace("ICT", "CNTT-TT")
print(x)
Chúng ta được kết quả của đoạn lập trình trên là:
Diễn đàn CNTT-TT dành cho các nhà nghiên cứu, giảng dạy và quản lý CNTT-TT
-
Nếu mà sửa đổi gen cũng đơn giản như lập trình thì tốt quá! 😊
Tất nhiên, chuỗi DNA khác với bộ nhớ máy tính. Chúng ta nhận thấy thách thức nằm ở các điểm sau:
- Làm thế nào để cắt được sợi DNA (cặp sợi xoắn kép hoặc sợi đơn)?
- Giả thiết rằng chúng ta có công cụ cắt sợi DNA rồi thì câu hỏi tiếp theo là làm thế nào để dò tìm chính xác đến các vị trí cần cắt? Sợi DNA nằm trong tế bào sinh vật chứ không phải trong bộ nhớ RAM của máy tính nên không thể áp dụng phương pháp “địa chỉ hóa” như trong lập trình được.
-
Giải đáp câu hỏi 1: Người ta sử dụng một loại enzyme có tên là nuclease để tác động lên chuỗi DNA. Nuclease có gì đặc biệt? Nó có khả năng cắt chuỗi DNA tại một điểm nào đó.
(Mở ngoặc:
Có lẽ chúng ta không nên đi sâu vào chi tiết về nuclease và enzyme nhưng nếu anh/chị có đủ nhiều thời gian thì có thể tham khảo ở đây:
Nuclease: https://en.wikipedia.org/wiki/Nuclease
Enzyme: https://en.wikipedia.org/wiki/Enzyme
Đóng ngoặc)
-
Câu hỏi 2 khó hơn. Chúng ta để ý rằng dưới góc độ thuật toán, hàm replace() trong Python, ở ví dụ trên, đầu tiên phải rà tìm đoạn ký tự “ICT”. Trong coding mẫu ký tự như đoạn “ICT” được gọi là pattern. Khi tìm thấy đoạn ký tự “ICT” thì hàm này cắt đoạn “ICT” khỏi chuỗi ký tự và sau đó thay vào đoạn mới là “CNTT-TT”.
Từ cuối những năm 1960, đầu những năm 1970, các nhà sinh học đã phát hiện một cơ chế phòng thủ của vi khuẩn (bacteria) trước sự tấn công của các virus. Cơ chế này rất thú vị: khi thấy xuất hiện “DNA lạ” (foreign DNA) vi khuẩn tự động sinh ra 2 chuỗi RNA ngắn. Một trong số này chứa pattern giúp dò tìm để “khớp” với DNA của virus lạ vừa thâm nhập. Hai chuỗi RNA ngắn này cùng với một protein có tên là Cas9 tạo thành một khối phức hệ (complex). (Cas9 là một nuclease. Và như chúng ta đã biết, nuclease có khả năng cắt DNA.) Khối phức hệ này dò tìm virus lạ bằng cách ghép so sánh RNA của khối này với DNA của virus (phép so sánh bù: A ↔ T, C ↔ G). Khi tìm thấy, complex này dùng Cas9 để cắt DNA của virus. Từ đó, vi khuẩn đã vô hiệu hóa virus.
Tóm tắt hệ thống miễn dịch của vi khuẩn: khi phát hiện có virus lạ tấn công, vi khuẩn phát sinh một đoạn RNA dẫn đường (guide RNA) tìm đến một vị trí khớp với DNA của virus và sử dụng Cas9 để cắt bỏ đoạn DNA tại vị trí đó.
Một cách hình ảnh: RNA dẫn đường (guide RNA) đóng vai trò là bàn tay, trỏ và kéo khối phức hệ (complex) đến vị trí cần tìm. Khi vào vị trí rồi thì dùng kéo phân tử (Cas9) để cắt DNA của virus tại vị trí đó.
-
Bên lề ▼
- DNA khác với RNA ở điểm nào? Chuyển sang thuật ngữ máy tính, DNA có thể xem như bộ nhớ trên đĩa còn RNA giống như bộ nhớ RAM. Cơ thể sống có một cơ chế “chép” thông tin từ DNA sang các phân tử RNA. Giống như trong máy tính chúng ta đọc file trên đĩa (DNA) và kết quả đọc được chép vào RAM (RNA). Một điểm khác biệt đáng chú ý nữa: DNA có cơ chế “tự sửa chữa” nếu bị cắt còn RNA thì không có cơ chế này. Tức là RNA của virus khi bị cắt thì không “tự lành” được.
- Vi khuẩn khác virus ở điểm nào? Vi khuẩn (bacteria) là một cơ thể sống. Virus không phải là một cơ thể sống, nó là một “phần mềm” “chạy” trên một cơ thể sống. Nếu protein bao bọc phần mềm virus lây nhiễm vào tế bào, thì RNA của chính nó sẽ chạy trên bộ máy của tế bào sống đó. Nếu thành công, cơ chế này sẽ biến tế bào thành một nhà máy sản xuất virus mới, khi được thoát ra, chúng có thể tiếp tục lây nhiễm sang các tế bào khác.
Bên lề ▲
🧬
② Nguyên lý chỉnh sửa gen bằng phương pháp CRISPR-Cas9
Gần đây, các nhà khoa học khi nghiên cứu hệ thống phòng thủ của vi khuẩn đã phát hiện ra rằng cơ chế này có thể áp dụng để cắt bất cứ chuỗi DNA nào một cách rất chính xác, không đơn thuần chỉ dùng để cắt chuỗi DNA của virus thâm nhập vào vi khuẩn. Phương pháp này không những áp dụng được trong ống nghiệm mà còn có thể áp dụng được vào nhân của tế bào sống. Một khi đã thâm nhập vào nhân tế bào, khối phức hệ (2 đoạn RNA + Cas9) sẽ gắn vào một chuỗi ngắn có tên là PAM. Cas9 lúc này tách DNA thành 2 sợi đơn và tìm cách khớp với RNA dẫn đường. Nếu khớp, Cas9 sử dụng chiếc kéo phân tử của mình cắt DNA tại đoạn khớp đó. Đoạn bị cắt đi có tên gọi là double-strand break (mối gãy sợi đôi). Khi việc này xảy ra, tế bào có cơ chế “tự sửa chữa”. Cơ chế tự sửa chữa này rất dễ bị lỗi, có thể dẫn đến các biến thể (mutation) xảy ra một cách ngẫu nhiên, gen bị hỏng, không còn hoạt động như mong đợi. Một phương pháp nữa mà các nhà khoa học thực hiện là thay đoạn DNA bị cắt đó bằng một đoạn DNA khỏe mạnh khác có chủ định. Sau khi đã thay thế, tế bào có cơ chế tự nối đoạn thay thế vào chỗ đoạn DNA bị cắt đi và được chuỗi DNA mới, là phiên bản mới của gen.
Chi tiết ▼ (chi tiết kỹ thuật: anh/chị bỏ qua nếu không có hứng thú đọc)
- Cấu trúc của guide RNA gồm 2 đoạn: CRISPR RNA (ký hiệu là crRNA) và trans-activating CRISPR RNA (gọi là RNA chuyển hoạt - ký hiệu là tracrRNA). Đoạn tracrRNA là khung cố định, hằng số - không đổi. Việc so sánh để khớp với gen chỉ xảy ra với đoạn crRNA.
- PAM là gì? PAM là viết tắt của protospacer adjacent motif. PAM có độ dài từ 2 đến 6 nucleotide. PAM được nối ngay phía đuôi của guide RNA (xem hình vẽ).
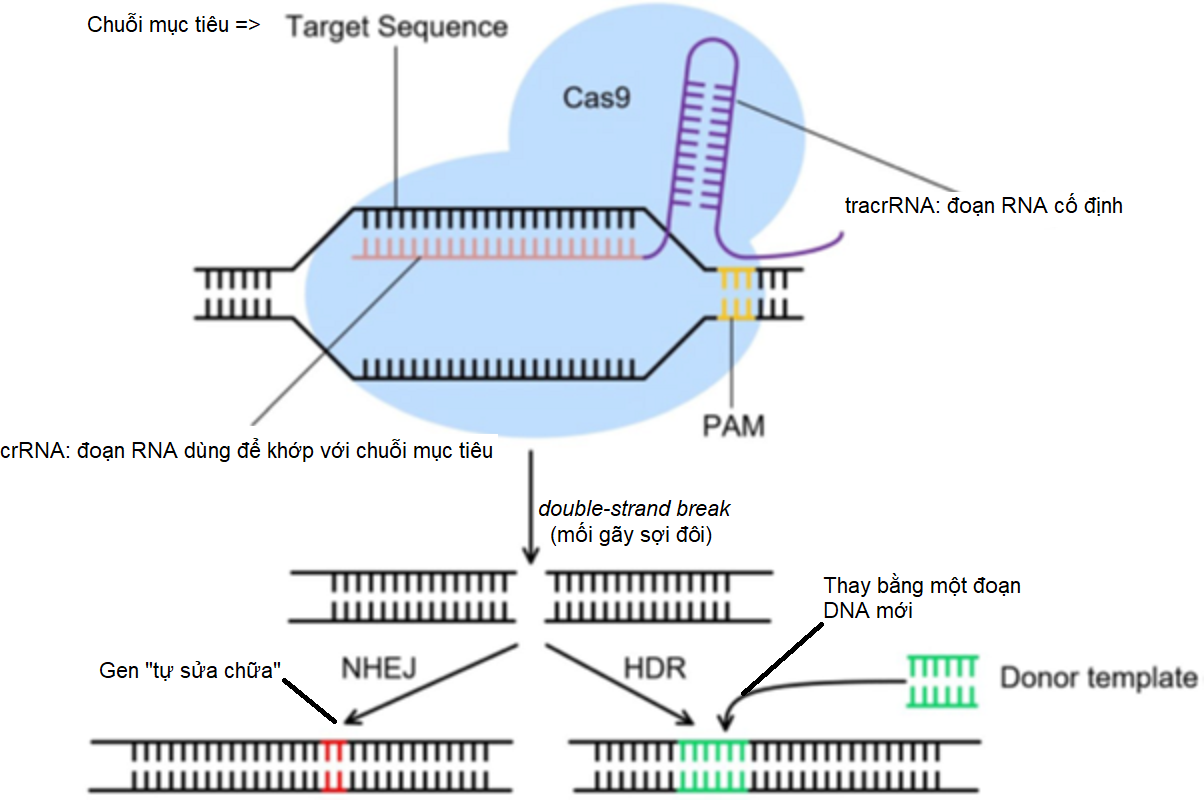
Sơ đồ cơ chế chỉnh sửa gen theo phương pháp CRISPR-Cas9.
- Khối phức hệ (nền xanh da trời) gồm 2 phần chính: guide RNA và Cas9.
- Guide RNA có 2 phần: phần tracrRNA cố định (màu tím) và phần crRNA có thể biến đổi (màu hồng).
- Vùng mục tiêu (target site) gồm 2 phần: chuỗi mục tiêu (màu đen) và PAM (màu vàng). Cas9 sẽ không cắt gen nếu không thấy PAM.
- Thuật toán chỉnh sửa gen:
- Tìm đoạn PAM trong toàn bộ gen.
- Sau khi dò tìm thấy PAM, Cas9 kiểm tra xem crRNA có khớp với đoạn DNA tương ứng không. Nếu thấy khớp, Cas9 cắt gen tại đoạn khớp (double-strand break - DSB).
- Sau khi cắt, DNA hoặc tự sửa chữa (theo nhánh NHEJ – đoạn bị cắt màu đỏ) hoặc thay thế bằng một đoạn DNA mới (theo nhánh HDR – đoạn thay thế màu xanh lá cây).
Chi tiết ▲
-
Tất cả quy trình trên có thể được thực hiện trong các gen nuôi cấy cho nhiều loại tế bào khác nhau. Quy trình có thể được thực hiện trong trứng đã thụ tinh cho phép tạo ra động vật chuyển gen với các biến thể theo chỉ định.
Và không giống như các phương pháp trước đây, CRISPR có thể được nhắm vào vùng mục tiêu (target site) trên nhiều gen cùng một lúc, một lợi thế lớn để nghiên cứu các bệnh phức tạp ở người không phải do một đột biến đơn lẻ gây ra mà do nhiều gen cùng tác động.
-
Bên lề ▼ Ai là tác giả của phương pháp CRISPR-Cas9?
- Vào năm 2012, Jennifer Doudna, Emmanuelle Charpentier, Martin Jínek, Krzysztof Chyliński, Ines Fonfara và Michael Hauer đã công bố phát hiện của họ rằng CRISPR-Cas9 có thể được lập trình bằng RNA để chỉnh sửa DNA bộ gen, hiện được coi là một trong những khám phá quan trọng nhất trong lịch sử sinh học. (Tham chiếu: A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial Immunity đăng ngày 28/06/2012)
- Khám phá này đã mang về cho Jennifer Doudna và Emmanuelle Charpentier giải Nobel Hóa học năm 2020.
- Anh/chị nào tò mò hơn có thể xem bài thuyết trình của Jennifer Doudna tại đây.
Bên lề ▲
-
🧬
③ Về thiết kế RNA dẫn đường (guide RNA)
Tôi xin có vài dòng bàn luận về thiết kế RNA dẫn đường (guide RNA) vì phần này có liên quan đến lập trình.
Chúng ta hãy hình dung một chuỗi DNA có chiều dài 3 tỷ bp (gen người) và chúng ta cần sửa đoạn gen nằm ở xung quanh địa chỉ 1,800,000,000. Đó là chúng ta nói theo ngôn ngữ của lập trình chứ chuỗi DNA không có địa chỉ như vậy. Vậy làm thế nào để xác định được đúng vị trí? Chú ý rằng chuỗi DNA là một sợi chuỗi xoắn kép và nó nằm trong nhân của tế bào, chứ không phải nằm trong bộ nhớ RAM của máy tính. Trong ngôn ngữ sinh học, người ta gọi một “địa chỉ” như vậy là target site (tạm dịch là vùng mục tiêu).
Target site là gì vậy? Quay trở lại ví dụ tôi đã lấy từ đầu bài bài post: giả thiết chúng ta có chuỗi ký tự:
“Diễn đàn ICT dành cho các nhà nghiên cứu, giảng dạy và quản lý ICT”.
Nếu lấy vùng mục tiêu là “ICT” thì chúng ta có đến 2 vùng mục tiêu khớp với “ICT” (sau cụm từ “Diễn đàn” và ở cuối chuỗi).
Nếu chúng ta lấy vùng mục tiêu là “nhà nghiên cứu” thì chúng ta tìm thấy duy nhất một vị trí – sau cụm từ “dành cho các”.
Như vậy, target site (vùng mục tiêu) chính là một đoạn DNA và đoạn này “khớp” (match) một cách duy nhất với guide RNA. Chú ý rằng phép toán “khớp” là so sánh bù (complement): A ↔ T, C ↔ G. Nghĩa là, ví dụ, nếu trên DNA của vùng mục tiêu có một nucleotide A thì trên guide RNA cần có nucleotide T để “khớp”, …
-
Một cách nôm na, chúng ta có thể hình dung việc thiết kế RNA dẫn đường (guide RNA) như sau:
- Đầu tiên, phải đọc được nội dung của toàn bộ chuỗi DNA (DNA sequencing) của gen. Thông thường nội dung của DNA được chọn từ các thư viện gen – nghĩa là các chuỗi DNA đã được giải trình tự từ trước và đã được lưu vào CSDL của các thư viện.
- Sau khi có chuỗi DNA của gen, chúng ta lại phải biết nội dung đoạn DNA của vùng mục tiêu (target site).
- Tiếp theo, chúng ta cần thiết kế RNA dẫn đường sao cho RNA này chỉ khớp duy nhất tại vùng mục tiêu (target site). Chú ý rằng vùng mục tiêu gồm chuỗi mục tiêu (target sequence) và PAM (xem hình vẽ ở trên).
- Thuật toán của tìm kiếm là khớp PAM trước rồi mới khớp chuỗi mục tiêu sau. Về mặt lý thuyết, việc này có vẻ rất đơn giản: chỉ cần thiết kế chuỗi bù (complement) của vùng mục tiêu rồi ghép với PAM là được. Thực tế không đơn giản như vậy:
- - Việc khớp PAM phải đảm bảo 100% khớp (PAM chỉ có chiều dài từ 2 đến 6 nucleotide).
- - Tuy nhiên, việc khớp với chuỗi mục tiêu nhất thiết phải 100%. Trong chuỗi mục tiêu chỉ cần đa số khớp, chấp thuận một thiểu số không khớp.
- - Các nucleotide khớp (matched) được gọi là on target (trúng mục tiêu).
- - Các nucleotide không khớp (mismatched) được gọi là off target (trật mục tiêu).
- - Tất nhiên, thiết kế tối ưu là phải tăng tỷ lệ trúng mục tiêu và giảm tỷ lệ trật mục tiêu.
- - Tỷ lệ trúng mục tiêu (on target) được gọi là tính hiệu quả (efficiency) – thường tính bằng %.
- Với tính chất như trên, chúng ta có cảm giác là thiết kế guide RNA ngắn sẽ dẫn đến số trật mục tiêu ít đi. Không hẳn, ngắn đến một mức độ nào đấy lại sinh ra nhiều nucleotide trật mục tiêu.
- Nếu thiết kế guide RNA quá dài cũng không được. Hiệu ứng là số trật mục tiêu tăng lên.
- Vậy con số tối ưu cho chiều dài của RNA dẫn đường là bao nhiêu? Theo các tài liệu tôi tham khảo thì con số này là khoảng từ 17 đến 24 nucleotide.
- Để thiết kế guide RNA, đương nhiên chúng ta cần sử dụng phần mềm!
-
Tôi không rõ là trong nước đã có đơn vị nào bắt tay vào sản xuất phần mềm loại này chưa?
Mời anh/chị tham khảo danh sách một số phần mềm thiết kế guide RNA: (nguồn)
- Synthego Design Tool
- Broad Institute GPP sgRNA Designer
- Off-Spotter
- CRISPR-Era
- Benchling CRISPR Guide RNA Design tool
- E-CRISP
- CRISPR.mit
- sgRNA designer
- E-CRISP
- CHOPCHOP
- CRISPRseek
- Cas-OFFinder
- CRISPRdirect
- CCTop
- CRISPRscan
- WU-CRISPR
- SSC
- CRISPR Multi-Targeter
- CLD
- CRISPOR
- GuideScan
- CASPER
🧬
⇨ Đọc thêm
Báo cáo với anh/chị, phần nhàn đàm đến đây có thể coi là kết thúc. Nghĩa là chúng ta đã phần nào hình dung ra cách sửa đổi một đoạn DNA (sửa đổi gen). Tuy nhiên, nếu anh/chị có chút thời gian, mời anh/chị tham khảo tiếp một số khía cạnh khác liên quan đến công nghệ gen (genetic engineering). Cũng giống như bất cứ một công nghệ nào khác, công nghệ gen có ứng dụng trong thực tế cuộc sống nhưng đồng thời nó cũng sinh ra các tranh cãi (controversies) và hàm chứa một số nguy cơ tiềm ẩn (risks).
Ứng dụng
Nói một cách vắn tắt thì công nghệ gen có các ứng dụng trong nông nghiệp, y tế, năng lượng và công nghiệp.
Nông nghiệp:
Một ứng dụng quan trọng của công nghệ gen là làm thay đổi kiểu gen của cây trồng để làm cho chúng có năng suất cao hơn, dinh dưỡng hơn, giàu protein, kháng bệnh và ít tốn phân bón hơn. Công nghệ DNA tái tổ hợp và kỹ thuật nuôi cấy mô có thể tạo ra các loại ngũ cốc, đậu và cây rau có năng suất cao.
Y tế:
Công nghệ gen đóng vai trò quan trọng trong việc sản xuất thuốc. Các vi sinh vật và các chất được chiết xuất từ thực vật hiện đang được sử dụng để sản xuất một lượng lớn thuốc hữu ích, vắc-xin, enzyme và hormone với chi phí thấp.
Liệu pháp gen (gene therapy) - các gen khỏe mạnh có thể được đưa trực tiếp vào một người có gen bị trục trặc - có lẽ là khía cạnh mang tính cách mạng nhất và hứa hẹn nhất của công nghệ gen.
Vắc-xin: Công nghệ gen cũng được sử dụng trong sản xuất vắc-xin phòng bệnh. Vắc-xin chứa một dạng sinh vật truyền nhiễm không gây bệnh nặng nhưng làm cho hệ thống miễn dịch của cơ thể hình thành kháng thể bảo vệ chống lại sinh vật truyền nhiễm. Vắc xin được điều chế bằng cách phân lập kháng nguyên hoặc protein có trên bề mặt của virus. (Chúng ta đã có dịp đàm luận về vắc-xin trên nền mRNA BNT162b2 (của Pfizer & BioNTech) và mRNA-1273 (của Moderna).)
Hormone (nội tiết tố): Cho đến gần đây, hormone insulin chỉ được chiết xuất với số lượng hạn chế từ tuyến tụy của bò và lợn. Quá trình này không chỉ tốn kém mà hormone đôi khi gây ra phản ứng dị ứng ở một số bệnh nhân tiểu đường. Kể từ năm 1982, insulin người đã được nhân bản với số lượng lớn trong vi khuẩn E. coli có thể được sử dụng để tổng hợp insulin.
…
Năng lượng:
Công nghệ gen có phạm vi rất lớn trong sản xuất năng lượng. Thông qua công nghệ này, giờ đây có thể tạo ra các loại cây theo mùa được nuôi trồng phát triển để tạo ra sinh khối khổng lồ, sử dụng làm nhiên liệu hoặc có thể được chế biến thành dầu, rượu, dầu diesel hoặc các sản phẩm năng lượng khác.
Công nghiệp:
Vi khuẩn biến đổi gen được đưa vào sử dụng để tạo ra các hóa chất công nghiệp. Nhiều loại hóa chất hữu cơ có thể được tổng hợp ở quy mô lớn với sự trợ giúp của các vi sinh vật biến đổi gen. Glucose có thể được tổng hợp từ sucrose với sự trợ giúp của các enzyme thu được từ các sinh vật biến đổi gen.
🧬
Tranh cãi (controversies)
Sự phát triển thương mại hóa của cây trồng biến đổi gen đã mang lại nhiều lợi ích kinh tế cho nông dân ở nhiều quốc gia khác nhau, nhưng nó còn gây ra nhiều cuộc tranh cãi về cây trồng biến đổi gen. Những tranh cãi này đã xuất hiện ngay từ thời kỳ đầu; những cuộc thử nghiệm biến đổi gen đầu tiên đã bị phá hủy bởi những người chống lại kỹ thuật biến đổi gen. Tuy giới khoa học đa số đã đồng thuận rằng những thức ăn được chế biến từ cây trồng biến đổi gen không có hại với sức khỏe hơn thức ăn tự nhiên, một số người vẫn lo ngại đến sự an toàn thực phẩm của thức ăn biến đổi gen. Trao đổi gen, mức độ ảnh hưởng tới những sinh vật khác, cách vận hành cung cấp thực phẩm, và sở hữu trí tuệ là những vấn đề đang trong vòng tranh cãi.
Những lo ngại này đã dẫn tới sự thành lập một khuôn khổ quy định từ năm 1975. Điều này dẫn tới hiệp ước quốc tế, Cartagena Protocol on Biosafety, được ký kết năm 2000. Tuy có hiệp ước, một số quốc gia lại đưa ra những hệ thống quy định riêng về GMO rất khác nhau, ví dụ có sự khác biệt lớn trong nhưng quy định này giữa Hoa Kỳ và Châu Âu.
🧬
Nguy cơ (risks)
Cái mà người ta rất lo ngại chính là nhờ có công cụ chỉnh sửa gen dễ dàng tiếp cận với chi phí thấp, làm nảy sinh nhiều vấn đề trước đây chưa từng có.
- Nguy cơ đầu tiên có thể nhìn thấy khá rõ ràng là tạo ra các hacker sinh học (biohackers): thực hiện các thí nghiệm có thể phát sinh các lỗi biến đổi gen (vô tình hoặc cố ý).
- Nguy cơ nữa là rủi ro và lợi ích của việc sửa đổi bộ gen của một người - các thay đổi được tạo ra sẽ truyền lại cho các thế hệ tương lai - phức tạp đến mức chúng cần phải được xem xét kỹ lưỡng. Những sửa đổi như vậy có thể gây ra những hậu quả khôn lường, có thể gây hại không chỉ cho đứa trẻ mà còn cho những đứa con tương lai, vì gen bị thay đổi sẽ có trong tinh trùng hoặc trứng của các thế hệ kế tiếp.
- Một số nguy cơ khác có thể kể đến là vũ khí sinh học (biological weapons) hoặc khủng bố sinh học (bioterrorists).
- Ngoài ra, người ta còn lo ngại sinh vật biến đổi gen có thể làm thay đổi hoàn toàn môi trường tự nhiên.
🧬
👇 Season’s greetings
Cuối cùng, để góp vui, tôi tưởng tượng là trong tương lai, các nhà khoa học trong nước sẽ cấy ghép, sửa đổi gen của Mèo phối hợp với biến thể gen Rồng của Việt Nam thời nhà Lý (đã tuyệt chủng nhưng sẽ được khôi phục?). Một con vật như vậy nhìn từa tựa như hình vẽ đính kèm theo đây.

Credit: DALL·E & Craiyon
-
Nhân dịp năm mới Quý Mão, trân trọng gửi đến anh/chị và gia đình lời chúc Tết: An khang thịnh vượng!
